EL VENCIMIENTO DE LA PATENTE DE HUMIRA ACELERA LA GUERRA POR LOS BIOSIMILARES
-
AbbVie, Roche, Amgen y Johnson & Johnson son las firmas más amenazadas con una caída de ingresos del 30% en los próximos años
-
Se calcula un ahorro superior a 2.000 millones para el Sistema Nacional de Salud español en 2020
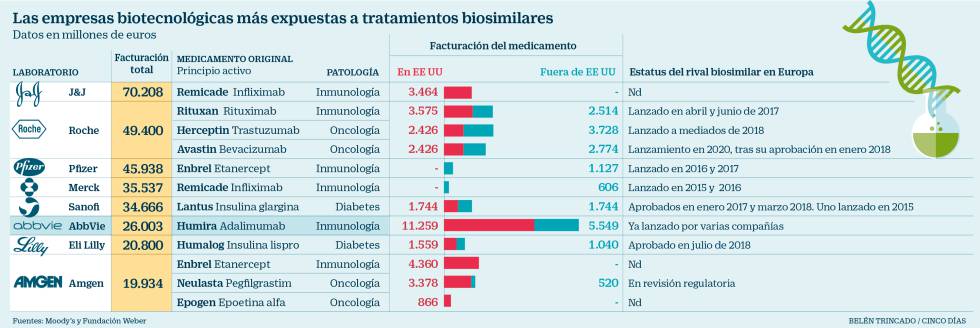
La deseada y disputada competencia se acelera en el mercado de los biológicos –aquellos medicamentos fabricados a partir de organismos vivos, como proteínas o anticuerpos–. El fármaco con mayores ventas en el mundo (15.000 millones de euros en 2017), el antiinflamatorio Humira, de la estadounidense AbbVie, perdió este mes su patente en Europa, lo que da entrada al biosimilar, o versión semejante del medicamento de referencia, y agudiza una guerra por un negocio superior a los 50.000 millones. Roche, Amgen y Johnson & Johnson son los otros gigantes farmacéuticos expuestos en los próximos 12-18 meses en esta lucha, según un informe de Moody’s.
De hecho, AbbVie acaba de anunciar en un comunicado que ha alcanzado un acuerdo de “licencia de propiedad intelectual no exclusiva” (a cambio de royalties) con Sandoz, una de las compañías rivales del grupo Novartis, para que su biosimilar de adalimumab, el principio activo de Humira, se comercialice a partir del día 16 de este mes en la mayoría de los países europeos y desde el 30 de septiembre de 2023 en EE UU, poniendo fin al litigio en el que estaban inmersas.
Imraldi, de Samsung Bioepis, es el biosimilar de Humira que se utilizará en España tras el acuerdo alcanzado entre la firma coreana y Sanidad
Un pleito que se suma a otros tres ya resueltos en 2017 y 2018 con las también estadounidenses Amgen, que lanzará su producto similar en suelo americano el 31 de enero de 2023; Samsung Bioepis, para el 30 de junio, y Mylan, el 31 de julio del mismo año. España ya tiene la versión un 30% más barata del Humira: Imraldi, de la coreana Samsung Bioepis, tras el convenio firmado entre este empresa y el Ministerio de Sanidad.
“A medida que los biosimilares ganan terreno en el mundo, las grandes biofarmacéuticas verán disminuir los ingresos de sus principales superventas (blockbusters) en 2018 y 2019, con caídas anuales de entre el 25% y el 30%. Su adopción en Europa ha sido firme y la tendencia indica el auge de su desarrollo, con más aprobaciones y lanzamientos”, pronostica Michael Levesque, vicepresidente sénior de Moody’s.
Potencial
Los fármacos biológicos (innovadores, complejos y caros) han supuesto una revolución en el sistema sanitario no solo porque han curado o mejorado la calidad de vida de pacientes con patologías graves como el cáncer, la diabetes, la artritis reumatoide, la psoriasis o la enfermedad de Crohn, sino también por su elevado coste (el tratamiento varía desde 11.000 hasta 300.000 euros por paciente) en un contexto de aumento de la cronicidad.
Por ejemplo, se estima que el número de diabéticos en España pasará de 2,5 a 5 millones en 2030, lo que da una idea del alza de la prevalencia y la carga que supondrá para unos presupuestos ya recortados. Incluso, Ramón Sánchez, director de la unidad de biosimilares de Amgen, apunta a que se utilizarán cada vez más para el tratamiento de cualquier dolencia, entre ellas, para algo tan común como la migraña. “Será el mundo de las medicinas biológicas, si siguen las tendencias”, afirma.
Datos de interés
Europa. Es una región pionera en el desarrollo de biosimilares. La Comisión Europea ha aprobado 49 fármacos que se utilizan para el tratamiento de enfermedades raras, inmunológicas, el cáncer, la diabetes u hormonas para favorecer el crecimiento y la fertilidad. Francia y Grecia son los países que más utilizan estas moléculas, mientras que en España su uso es conservador, apuntan médicos y laboratorios.
Expansión. Los biosimilares son todavía un negocio incipiente si se compara con el de genéricos, debido a que su marco regulatorio es nuevo y está pendiente de modificaciones. La expiración de patentes en el mercado de los biológicos es menor a la producida en los de síntesis química y hay menos empresas por la complejidad y el elevado coste de fabricación.
Previsión. El mercado crecerá a medida que el regulador apruebe más fármacos, que se eleve el uso en los pacientes y se resuelvan los litigios entre los laboratorios, vaticina Moody’s.
La consultora británica EvaluatePharma prevé que los biológicos representarán el 25% de los 800.000 millones de dólares (unos 697.926 millones de euros) en prescripción global de fármacos, cita Moody’s. En Europa suponen hoy el 27% del valor de las ventas totales de medicamentos, debido fundamentalmente a la adquisición de los anticuerpos monoclonales (para patologías inflamatorias o el cáncer).
Bondades
De ahí la importancia de los biosimilares. “Es necesario que estimulemos la competencia si queremos tener medicamentos altamente innovadores a un menor coste; mientras más pacientes lo usen, más bajará su importe. De lo contrario, habrá que pagar precios elevados, muchas veces injustificados”, defiende Carlos Lens, ex subdirector general de calidad de medicamentos y productos sanitarios del Ministerio de Sanidad.
El mayor acceso a terapias así como el ahorro que supone para el sistema sanitario español, cuyo gasto va en aumento (representa el 6% del PIB), son sus principales atractivos. Además, proporciona alegría a las cuentas empresariales. “Tanto las farmacéuticas de marcas como de genéricos han puesto los biosimilares en el punto de mira como vía para hacer crecer sus ingresos futuros. Esperamos la expansión de los porfolios y que más compañías se interesen por este mercado”, añade Levesque, de Moody’s.
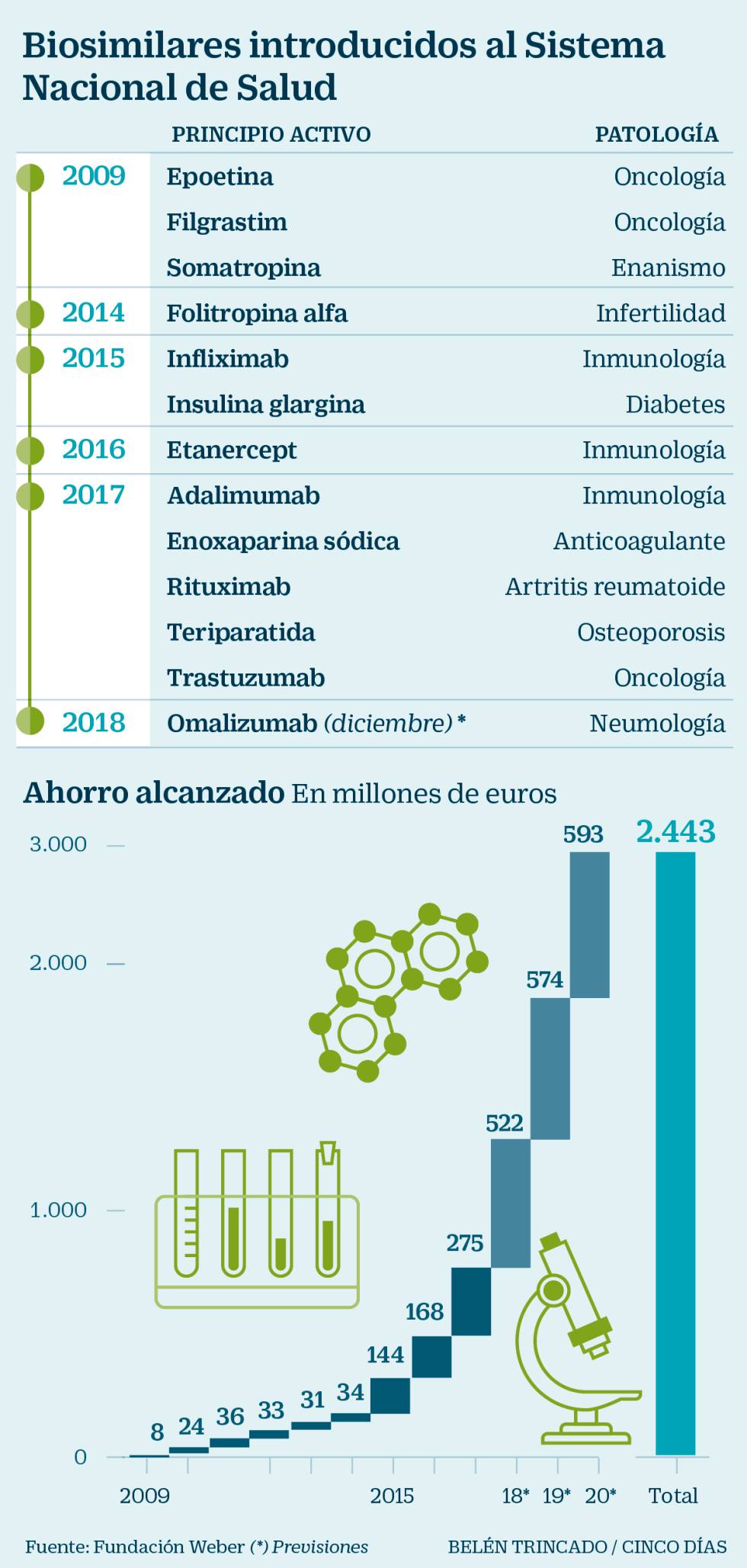
Entre los gestores hospitalarios pesa sobre todo la búsqueda de la eficiencia y la sostenibilidad del sistema sanitario. Un informe reciente de la Fundación Weber recoge que el Sistema Nacional de Salud español (SNS) se ahorró 478,35 millones de euros entre 2009 y 2016 después de la introducción de los biosimilares de la insulina glargina (25%), de la somatropina (21%), el infliximab (20%), el filgrastrim (16%) y la epoetina (13%).
No obstante, el mayor impacto se registró en 2016, tras la incorporación un año antes del infliximab y la insulina glargina, para un total de 113,8 millones, detalla el documento. Esta merma respondió más a la disminución de precios de los biológicos originales que a la compra directa de biosimilares, destaca el estudio.
Pero la cifra de ahorro aumentará a 2.400 millones en 2020, “siempre que se incremente su penetración”, vaticina el estudio, que analiza solo los primeros ochos años de entrada en el mercado de estos medicamentos. Además, se calcula que representará el 2,98% del gasto farmacéutico total y el 6,49% del hospitalario anuales en dos años.
La compra de biosimilares en España en 2011 fue de 2.800 millones –último dato disponible–, lo que supuso el 30% del gasto global en medicamentos del SNS y el 46% del hospitalario, con tendencia al alza en el futuro. Así, pese a las reticencias, el negocio biosimilar promete.
La penetración en España, aún escasa

No solo el recelo de las grandes farmacéuticas a perder sus derechos de comercialización exclusivos influye en la poca penetración de los biosimilares en España, afirma Regina Múzquiz, directora general de la Asociación Española de Biosimilares (BioSim).
También inciden las lagunas regulatorias, la falta de información, formación y consenso entre gestores y clínicos –las decisiones de precripción son colegiadas–, admitieron los profesionales sanitarios en una jornada sobre el tema organizada por la patronal BioSim, el laboratorio Amgen y la Asociación Nacional de Informadores de la Salud (ANIS).
Y aún cuando su eficacia y seguridad está más que probada –igual que al resto de medicamentos, el regulador exige los mismos controles estrictos de calidad e inspección, recuerdan desde la Agencia Española del Medicamento–, persiste alguna leyenda urbana sobre lo contrario.
La sustitución o intercambio de un biológico por un biosimilar es otro de los debates sobre la mesa que genera incertidumbre en el ámbito hospitalario, a pesar de los más de 10 años de su uso en el sistema, reconoce Olga Delgado, jefa del servicio de farmacia del Hospital Universitario Son Espases de Palma de Mallorca.
¿Por qué? Delgado cree que el ahorro no debe ser la única razón para utilizarlos, sino también el beneficio clínico. Por ejemplo, a veces un biológico de segunda generación es más efectivo respecto a los costes-beneficios que un biosimilar, y en ese caso, no hay por qué sustituirlo; “se debe valorar molécula a molécula”, considera.
O la determinación de informar a los pacientes del cambio. Mientras Delgado cree que no es necesario porque puede generar un efecto nocebo (empeoramiento de los síntomas y abandono de la terapia por la percepción de que es un fármaco de menor calidad), Miguel Ángel Abad, del servicio de reumatología del Hospital Virgen del Puerto de Plasencia (Extremadura), opina lo contrario. Y sobre quién recae la potestad de la indicación: debería ser sobre el médico, sugieren, pero, en ocasiones, el servicio de farmacia hospitalario cambia el fármaco como si se tratara de un genérico, constatan.
Ramón Sánchez, director de la unidad de biosimilares de Amgen, añade la visión cortoplacista de la Administración. Por eso su penetración es también desigual si se analiza por comunidad autónoma. “Hay que homogeneizar la gestión”, concluyen.
Fuente: Cinco Días
Volver